Was ist ein Medizinprodukt?

Medizinprodukte unterliegen strengen Regeln, die auf u.a. Sicherheit überprüft sein müssen und deren medizinische Wirkung nachgewiesen sein muss. Um
Medizinprodukte zu entwickeln, herzustellen und in den Verkehr zu bringen, benötigt man ein zertifiziertes Qualitätsmanagementsystem, welches extern auditiert wird. Ohne ein
Qualitätsmanagementsytem darf man keine Medizinprodukte entwickeln oder Produzieren!
Vorsicht! Viele Onlinehändler bieten Medizinprodukt ähnliche, vermeindlich günstige Produkte an, die nicht ordnungsgemäß zertifiziert wurden. Händler und
Produkte werden nicht von offizieller Stelle überprüft. Achten Sie beim Kauf zu Ihrer Sicherheit auf lückenlose Zertifizierungen! Wichtig ist die Erklärung des Herstellers in alleiniger
Verantwortung, dass das Produkt die Anforderungen der EU und der Mitgliedsländer einhält, die sogenannte Konformitätserklärung.
Gekennzeichnet sind Produkte der Klasse IIa wie der VenenWalker mit dem CE Symbol und einer 4-stelligen Kennnummer der Benannten Stelle, welche die Prüfung der Technischen Dokumentation des Produktes durchgeführt hat.
Ein Medizinprodukt ist kein Medikament, kein Arznei- oder Heilmittel, kein Nahrungs-Ergänzungsmittel. Es wirkt z.B. als Pflaster oder Blutdruckmessgerät am Körper. Und z.B. als künstliches Hüftgelenk oder Herzschrittmacher im Körper. Und dass, ohne dabei wie ein Medikament in den Stoffwechsel des Menschen einzugreifen. Es geht hier um Medizinprodukte, zu den auch unser VenenWalker® gehört.
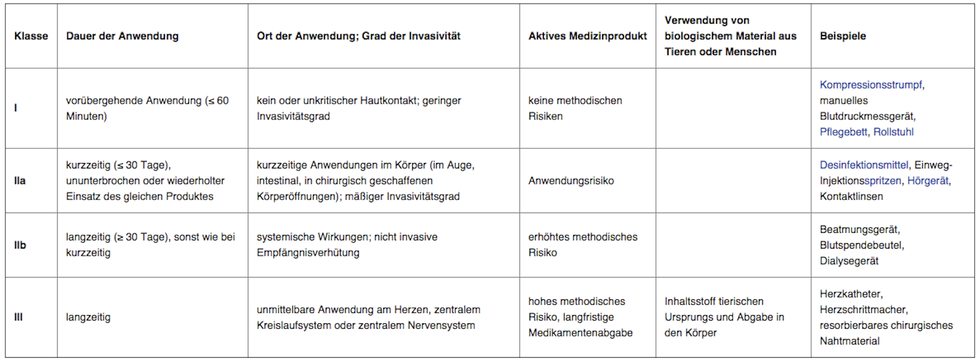
Als Medizinprodukte werden Geräte, Apparate, Instrumente und andere Gegenständen bezeichnet, die in der Medizin eingesetzt werden. Die große Breite der Medizinprodukte reicht vom schlichten Verbandszeug und Pflaster bis zu komplexen HighTech-Röntgengeräten und wird in vier Risikoklassen aufgeteilt. Ausschlaggebend für die Zuordnung eines Medizinprodukts in eine dieser Risikoklassen ist zum Beispiel, ob es außen in der Nähe der Haut oder auf der Haut eingesetzt wird – oder ob es im Körper angewendet wird. Fragen zur Zuordnung der Risikoklasse sind auch, wie lange das Medizinprodukt am oder im Körper bleibt oder ob es mit Strom betrieben wird.
Die niedrigste Risikoklasse ist natürlich die Klasse I, in die zum Beispiel Pflaster, Verbandmaterial oder Rollstühle eingestuft werden. Der Gesetzgeber sieht unter anderem Kontaktlinsen und Zahnkronen als Medizinprodukte mit mittlerem Risikopotential an und stuft sie in die Klasse IIa ein. Hohes Risikopotential wird in der Klasse IIb versammelt, hier finden sich z.B. Dialyse- und Röntgengeräte. Externe Herzschrittmacher, Herz-Lungen-Maschinen, Hüftprothesen Brustimplantate – in die Klasse III werden alle Medizinprodukte mit sehr hohem Risikopotential eingestuft, die z.B. direkt am Herzen oder Gehirn angewandt werden.
Um überhaupt verkaufbar zu werden und in den Handel zu gelangen, muss ein neues Medizinprodukt erst einmal ein Verfahren zur Konformitätsbewertung durchmachen. Dieser Vorgang ist mit einer Zulassung vergleichbar und fordert vom Hersteller den Nachweis, dass sein Medizinprodukt sicher ist. Der Hersteller muss weiter nachweisen, dass die technischen und medizinischen Leistungen so erbracht werden, wie in der Leistungsbeschreibung formuliert wurde. Eine klinische Prüfung als ein Teil des Konformitätsbewertungsverfahrens wird unter bestimmten Umständen erforderlich. Klinische Daten zum neuen Medizinprodukt werden dann gesammelt und ausgewertet, wenn die Sicherheit und Leistungsfähigkeit des Produkts nicht vollständig auf andere Art nachgewiesen werden kann. Das kann z.B. geschehen durch bereits vorhandene klinische Daten gleichartiger Medizinprodukte. Falls aber eine klinische Prüfung unumgänglich ist und durchgeführt werden soll, muss der Hersteller erst die Zustimmung einer Ethikkommission und die Genehmigung der zuständigen Bundesoberbehörde einholen.
Produktklassen - bei Medizinprodukten
Die Produktklassen I, IIa, IIb und III eines Medizinproduktes werden durch das Gefährdungspotential gekennzeichnet, wobei die Produktklasse III das höchste Gefährdungspotential enthält. Die Merkmale zur Klassifizierung sind in Europa in der Richtlinie 93/42/EWG festgelegt. Sie betreffen Verwendungszweck, Anwendungsort und Anwendungsdauer des Medizinproduktes. Die Klassifizierung anhand dieser Merkmale erfolgt durch den Hersteller und wird (durch eine sogenannte Benannte Stelle) in einem Verfahren zum Nachweis der Erfüllung aller gesetzlichen Produktanforderungen zertifiziert (Zertifizierung der Konformitätsbewertung). Mit der CE-Kennzeichnung bestätigt der Hersteller die vollständige Einhaltung der „Grundlegenden (Sicherheits-) Anforderungen“, die in den entsprechenden EU-Richtlinien festgelegt sind.